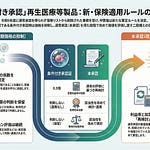
中央社会保険医療協議会(中医協)総会(第641回、令和8年1月14日開催)において、再生医療等製品「エレビジス点滴静注」の医療保険上の取扱いが審議されました。本品はデュシェンヌ型筋ジストロフィー(DMD)に対する遺伝子治療製品であり、令和7年5月13日に条件及び期限付承認を取得しています。中医協では、承認審査の経緯、安全対策の状況、保険適用の方針という3つの観点から議論が行われました。
本品は、米国で既に本承認されており、長期の経過観察により有効性の確認が可能になると期待されています。主要評価項目では統計学的有意差は認められなかったものの、副次評価項目で運動機能の改善が確認されました。海外の歩行不能患者(適応外)における死亡例を受けて安全対策が強化されており、関連学会との連携体制も整備されています。今回の審議では、医薬品の例により対応し、薬価算定組織で償還価格を検討する方針が示されました。
エレビジス点滴静注の製品概要
エレビジス点滴静注は、DMD患者の筋機能改善を目的とした遺伝子治療製品です。本品は中外製薬株式会社が製造販売を行い、希少疾病用再生医療等製品として承認されました。適応は、抗AAVrh74抗体が陰性、歩行可能、3歳以上8歳未満のいずれも満たすDMD患者に限定されています。
本品の作用機序は、マイクロジストロフィンタンパク質の発現による筋機能の改善です。静脈内に投与された本品が骨格筋細胞および心筋細胞に感染し、搭載された遺伝子が細胞核内にエピソームとして留まります。この遺伝子から発現したマイクロジストロフィンタンパク質が筋細胞膜を安定化させることで、筋破壊を防ぎ、筋機能の改善が期待されます。
投与方法は、体重に応じた用量を60分から120分かけて静脈内に単回投与します。体重10kg以上70kg未満の患者には1.33×10¹⁴ベクターゲノム/kgを、体重70kg以上の患者には9.31×10¹⁵ベクターゲノムを投与します。再投与は行いません。
製造販売承認審査の経緯と有効性評価
本品の承認審査では、有効性の評価方法と過去の再生医療等製品との比較が論点となりました。令和7年5月14日の中医協総会において、1号および2号委員から有効性推定の根拠と本承認の見通し、過去に保険適用から削除された2製品(ハートシート、コラテジェン)の課題を踏まえた審査であるかについて説明を求める意見が出されました。
主要評価項目のNSAA総スコアでは、プラセボ群に対する優越性は示されませんでした。NSAA総スコアとは、4歳以上のDMD男児における歩行能力を評価するために開発された機能尺度です。第Ⅲ相試験(301試験)は4歳以上8歳未満の男児患者125例を対象に実施され、NSAA総スコアのベースラインから投与後52週までの変化量は、本品群(63例)で2.52±3.31、プラセボ群(61例)で1.86±3.18でした。調整済み平均値の群間差は0.65(95%CI:-0.45〜1.74)であり、統計学的に有意な差は認められませんでした。なお、承認された適応は3歳以上8歳未満の患者であり、臨床試験の対象年齢より1歳低く設定されています。
一方、副次評価項目では運動機能の改善が確認されました。床上起き上がり時間では群間差-0.64秒(95%CI:-1.06〜-0.23)、10m歩行/走行時間では群間差-0.42秒(95%CI:-0.71〜-0.13)、4段階段昇り時間では群間差-0.36秒(95%CI:-0.71〜-0.01)と、本品群でプラセボ群と比較して改善が認められました。これらの指標は疾患進行に伴う微細な変化を早期に捉えやすいとされています。
探索的試験の長期追跡結果では、本品の効果がより明瞭に観察されました。本品投与後3年時点のNSAA総スコアの変化量は、本品群で-1.43、外部対照群で-4.63であり、調整済み平均値の群間差は3.20(95%CI:0.52〜5.89)でした。この結果から、時間経過に伴い本品の効果が大きくなる傾向が認められています。
301試験の2年追跡結果も学会発表されており、外部対照群との比較でNSAA総スコアに統計学的有意差が示されました。投与後2年までの変化量は、本品群で2.6±5.13、外部対照群で-0.3±5.18であり、調整済み平均値の群間差は2.88(95%CI:1.43〜4.33、p=0.0001)でした。ただし、この解析は多重性の調整がされていない名目値です。
過去の2製品との比較では、本品はより確実な有効性評価が可能です。コラテジェンおよびハートシートは条件及び期限付承認後に新たな患者を対象とした調査が設定されましたが、本品では301試験に登録した患者を対象に引き続き3年間のデータ収集を行う計画です。また、令和6年3月に策定されたガイダンスに基づいて審査が行われており、より確度の高い運用が行われています。
なお、令和7年9月24日に欧州委員会は本品の条件付き販売承認を不承認としました。有効性が十分に証明されていないという見解が示されましたが、欧州の製造販売業者であるロシュ社は欧州医薬品庁との当局相談を実施する計画です。
安全対策の強化と関連学会との連携体制
本品の安全対策は、海外での死亡例を契機に強化されました。令和7年6月16日に製造販売業者から、海外の歩行不能患者における急性肝不全の死亡例が報告され、8月28日に医薬安全対策課から添付文書改訂が指示されました。なお、本品の適応は「歩行可能な患者」に限定されており、この死亡例は適応外の患者で発生したものです。
令和7年11月27日の薬事審議会医療機器・再生医療等製品安全対策調査会では、4つの論点について議論が行われました。第一に、本品投与前の肝機能検査の実施および投与可否の判断です。第二に、本品投与前のステロイド投与に関連する注意喚起です。第三に、本品投与後に肝機能障害が発現した場合の対応です。第四に、他科・他施設との連携および専門家への相談体制の確保です。これらの論点に基づき、適正使用ガイドでは投与前の肝機能検査の実施および投与可否の判断手順が明確化されました。
適正使用ガイドには、多層的な連携体制が整備されました。肝機能障害発生時には、投与施設が小児患者に対応できる肝臓専門医のいる連携先、エキスパートパネル、日本肝臓学会からの協力を得られる体制が明確化されています。
関連学会への通知も発出されました。令和7年12月17日に日本小児神経学会および日本肝臓学会宛に通知が発出され、適正使用指針に基づく認定医療機関への安全対策の徹底、認定医療機関間での知識・経験の共有、肝機能障害発生時の連携先確保について協力が求められています。
医療保険上の取扱いの方針
本品の医療保険上の取扱いは、医薬品の例により対応する方針が示されました。平成26年11月5日の中医協総会で了承された再生医療等製品の保険適用に係る取扱いに基づき、本品の特性を踏まえて判断されています。
保険適用の手続きを進める根拠は、米国での本承認と長期観察による有効性確認の見通しです。本品は米国で既に本承認されており、長期の経過を確認することにより有効性の確認が可能な状況になることが合理的に予想されています。先行する米国と同様の判断になり得ると期待されることから、保険適用の手続きを進めることとされました。
医薬品の例により対応する理由は、本品の作用機序と投与方法にあります。審査報告書では、本品に搭載された遺伝子発現構成体が細胞の核内にエピソームとして留まり、心筋、呼吸筋および骨格筋内で機能的なマイクロジストロフィンタンパク質を発現するとされています。発現したマイクロジストロフィンタンパク質が筋細胞膜に局在し筋機能を改善すること、および本品は静脈内に注射して投与する点が医薬品のような投与法であることを踏まえ、医薬品の例により対応することとされました。
今後の手続きは、薬価算定組織での償還価格の検討と中医協総会での審議です。薬価算定組織において償還価格について検討し、その結果を踏まえて中医協総会で薬価基準への収載について審議されます。
まとめ
エレビジス点滴静注の医療保険上の取扱いについて、中医協総会で審議が行われました。本品はDMDに対する遺伝子治療製品であり、条件及び期限付承認を取得しています。主要評価項目では統計学的有意差は認められなかったものの、副次評価項目で運動機能の改善が確認され、長期追跡では効果がより明瞭になる傾向が示されています。海外での死亡例を受けて安全対策が強化され、関連学会との連携体制も整備されました。本品は医薬品の例により対応し、薬価算定組織で償還価格を検討した上で、薬価基準への収載が審議される予定です。