令和7年12月26日、中央社会保険医療協議会は「令和8年度薬価制度改革の骨子」を了解しました。この骨子に基づき、薬価算定基準の改正案が示されています。本稿では、令和8年度薬価改定における主要な見直し内容を解説します。
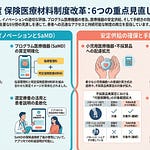
今回の改定は、国民負担の軽減と創薬イノベーションの両立、後発品を中心とした医薬品の安定供給確保、高額医薬品への対応の3つを柱としています。具体的には、新薬創出・適応外薬解消等促進加算の名称を「革新的新薬薬価維持制度」に変更すること、長期収載品の薬価適正化を強化すること、後発品の価格帯集約ルールを見直すこと、市場拡大再算定の類似品への適用を廃止することが主な改正点です。
1. 国民負担の軽減と創薬イノベーションを両立する評価制度
今回の改定では、新薬の適切な評価と既収載品の価格適正化を通じて、国民負担の軽減と創薬イノベーションの両立を図ります。薬価算定方法の見直し、補正加算制度の改善、新薬創出等加算の再編成、市場拡大再算定の名称変更と類似品適用の廃止、長期収載品の薬価適正化強化が実施されます。
類似薬効比較方式における算定方法の変更
類似薬効比較方式において、比較薬が特定の補正加算を受けている場合の算定方法が変更されます。比較薬が市場性加算(Ⅰ)、市場性加算(Ⅱ)、特定用途加算、小児加算、先駆加算、迅速導入加算の適用を受けている場合は、当該加算額を控除した額を比較薬の薬価とみなして一日薬価合わせを行います。この変更により、新薬が比較薬と同じ補正加算の適用を受けることが可能となります。
原価計算方式における販売費及び一般管理費の計上
原価計算方式における販売費及び一般管理費の係数について、運用上の対応が明確化されます。希少疾病用医薬品等では、平均を超えた係数を用いることが妥当とされる場合、上限である70%を超えた係数を用いることが可能であることが明確化されます。
市場性加算(Ⅰ)と小児加算の併加算が可能に
成人及び小児の同時開発を促進するため、市場性加算(Ⅰ)と小児加算の併加算が可能となります。ただし、小児のみが希少疾病用医薬品の指定範囲とされた場合は除外されます。また、市場性加算(Ⅰ)の加算率について、原則として現行の加算率の範囲(下限10%)を維持しつつ、希少疾病用医薬品の指定基準への該当性の内容に応じて、例外的に5%とすることが可能となります。治験実施の困難さ等を踏まえて加算率を柔軟に判断することとされています。
規格間調整のみによる新薬の薬価算定における補正加算
規格間調整のみによる新薬の薬価算定において、新薬が市場性加算(Ⅰ)、先駆加算または迅速導入加算の要件を満たす場合には、これらの補正加算の適用を受けることが可能となります。
標準的治療法に関する薬価改定時の加算
薬価収載時に標準的治療法に関する補正加算を適用していない品目について、新たな評価の仕組みが導入されます。薬価収載後に、新たに一般診療に用いられている国内の診療ガイドラインにおいて標準療法となったと評価できる場合は、薬価改定時に加算を適用することとなります。
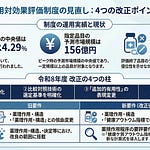
新薬創出等加算から「革新的新薬薬価維持制度」への名称変更
新薬創出・適応外薬解消等促進加算の名称が「革新的新薬薬価維持制度」に変更されます。英語名は「Patent-period price Maintenance Program for Innovative Drugs (PMP)」です。この名称変更により、特許期間中の革新的な新薬の薬価が維持されることがより明確になります。
品目要件についても見直しが行われます。制度の透明性を高める観点から、以下の医薬品については品目要件から削除され、今後新たに薬価収載される品目には適用しないこととなります。第一に、新規作用機序医薬品または新規作用機序医薬品に相当すると認められる効能若しくは効果が追加されたものであって、別表10の基準に該当する医薬品です。第二に、新規作用機序医薬品(別表10の基準に該当するものに限る)を比較薬として算定された医薬品または新規作用機序医薬品を比較薬として算定された医薬品を比較薬として算定された医薬品です。乖離率が平均乖離率を超える品目は引き続き対象外となります。
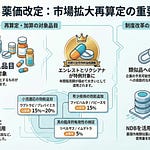
市場拡大再算定の特例から「持続可能性特例価格調整」への名称変更
市場拡大再算定の特例の名称が「持続可能性特例価格調整」に変更されます。英語名は「Special Price Adjustment for Sustainable Health System and Sales Scale (SPA-SSS)」です。この名称変更により、イノベーションの評価と国民皆保険の維持を両立するための対応という趣旨が明確化されます。
市場拡大再算定の類似品への適用廃止
企業の予見可能性を確保し、国民負担の軽減と創薬イノベーションを両立する観点から、市場拡大再算定または持続可能性特例価格調整対象品の類似品への市場拡大再算定または持続可能性特例価格調整の適用は廃止されます。
市場拡大再算定または持続可能性特例価格調整対象品目の薬理作用類似薬については、効能追加等の有無に関わらず、レセプト情報・特定健診等情報データベース(NDB)により使用量を把握し、薬価改定以外の機会も含め、市場拡大再算定または持続可能性特例価格調整を実施することとなります。
長期収載品の薬価の更なる適正化
長期収載品に依存するビジネスモデルからの脱却を促進するため、薬価上の措置が大幅に見直されます。後発品への置換え期間は後発品上市後5年とし、5年を経過した長期収載品の薬価は後発品置換率によらずG1を適用します。G1適用後は後発品の加重平均薬価を基準として段階的に引き下げられます。
G1品目の引下げ方式は次のとおりです。G1品目に該当してから初めて薬価改定を受ける品目は後発品価格の加重平均値の2.5倍、2年経過後は2倍、4年経過後は1.5倍、6年経過後は加重平均値となります。Z2およびG2は廃止されます。
補完的引下げ(C)は廃止され、G1の補完的引下げは後発品置換率によらず薬価の引下げ率を2.0%とします。G1適用後の薬価は、G1による引下げ後の額と2.0%の補完的引下げ後の額のうち、いずれか低い額となります。後発品の加重平均薬価まで価格を引き下げた長期収載品にはG1を適用しません。
バイオシミラーが収載されているバイオ先行品についてもG1が適用されます。
長期収載品の引下げの下限及び円滑実施措置
引下げの下限及び円滑実施措置については廃止されます。ただし、令和8年度薬価制度改革における長期収載品の薬価の更なる適正化では大きな制度変更を行うことから、令和8年度薬価改定に限り、これらの措置が適用されます。
具体的には、品目ごとに引下げ率が50%を超えるものについては50%を上限として適用されます。また、企業ごとに影響率(当該企業の医療用医薬品の総売上に対する本規定の適用により減少すると見込まれる売上の割合)が5%を超える企業については、円滑実施係数を乗じた率となるように適用されます。
令和6年度薬価制度改革時点でG2に該当した品目の経過措置
令和6年度薬価制度改革時点においてG2に該当した品目については、以下のとおり取り扱われます。G2品目に該当してから初めて薬価改定を受けるものまたはG2品目に該当してから2年を経過した後に初めて薬価改定を受けるものは、G1品目に該当してから2年を経過した後に初めて薬価改定を受けるものとして取り扱われます。G2品目に該当してから4年を経過した後に初めて薬価改定を受けるものまたはG2品目に該当してから6年を経過した後に初めて薬価改定を受けるものは、G1品目に該当してから4年を経過した後に初めて薬価改定を受けるものとして取り扱われます。
オーソライズド・ジェネリック(AG)・バイオAGの取扱い
先発品と有効成分、原薬、添加物、製法等が同一のバイオ医薬品であって、後発品として薬事承認を受けたもの(バイオAG)の薬価は、今後新たに薬価収載される品目に限り、バイオ先行品の薬価と同額となります。この措置により、バイオ後続品(いわゆるバイオシミラー)との適切な競争環境の形成・維持が図られます。
オーソライズド・ジェネリック(AG)についても、後発品の適切な競争環境の形成・維持のため、先発品と有効成分、原薬、添加物、製法等が同一の後発品(今後新たに薬価収載される品目に限る)の薬価は、先発品の薬価と同額となります。
先発品の薬価と同額で算定されたAGまたはバイオAGについては、薬価改定時に当該AGと先発品、当該バイオAGとバイオ先行品について、それぞれ薬価を加重平均し価格帯を集約します。
2. 後発品を中心とした医薬品の安定供給確保のための対応
医薬品の安定供給を確保するため、後発品の価格帯集約ルールの見直しと薬価の下支え制度の充実が図られます。
後発品の価格帯集約ルールの見直し
注射薬およびバイオシミラーについては、同一規格・剤形内の品目数が少ない状況を踏まえ、最高価格の30%を下回る薬価のものを除き、価格帯集約の対象外となります。G1品目に係る後発品の1価格帯集約は廃止されます。
企業指標の評価結果を活用した価格帯集約の特例において、対象企業、対象品目、適用条件のすべての要件を満たす品目については、注射薬またはバイオシミラーに該当しない品目であっても、価格帯集約の対象外となります。
最低薬価の見直し
最低薬価について複数の改正が行われます。外用塗布剤については規格単位に応じた最低薬価が新設されます。点眼・点鼻・点耳液については点眼剤の最低薬価が適用されます。
最低薬価は全体的に引き上げられます。ただし、令和7年度薬価調査結果において前回の令和6年度薬価調査における最低薬価品目の平均乖離率を超えた乖離率であった品目は引き上げの対象外となります。引き上げた最低薬価を下回る価格の基礎的医薬品については、引き上げ後の最低薬価と同水準までその薬価が引き上げられます。
不採算品再算定の見直し
不採算品再算定について、従来の「当該既収載品と組成、剤形区分及び規格が同一である類似薬がある場合には、全ての類似薬について該当する場合に限る」という要件が削除されます。該当する類似薬のシェアが5割以上であって他の要件を満たす場合は、不採算品再算定の対象となります。
組成、剤形区分及び規格が同一である全ての類似薬の乖離率の平均が全ての既収載品の平均乖離率を超える品目は不採算品再算定の対象外となります。
不採算品再算定の適用は医療上の必要性が特に高い品目を対象とします。具体的には、基礎的医薬品とされたものと組成及び剤形区分が同一である品目、重要供給確保医薬品に位置付けられている品目、極めて長い使用経験があり供給不足による医療現場への影響が大きいと考えられる品目が対象となります。極めて長い使用経験がある品目とは、昭和42年以前に収載された医薬品を指します。
3. 高額な医薬品に対する対応
高額な医薬品に対する対応として、市場拡大再算定および持続可能性特例価格調整の適用が強化されます。
年間1,500億円の市場規模を超えると見込まれる高額な医薬品およびその類似薬については、効能追加等の有無に関わらず、レセプト情報・特定健診等情報データベース(NDB)により使用量を把握します。この使用量把握に基づき、薬価改定以外の機会も含め、市場拡大再算定または持続可能性特例価格調整が実施されます。
持続可能性特例価格調整の引き下げ幅の上限についても見直しが行われます。年間1,500億円の市場規模を超えると見込まれる高額な医薬品に対する持続可能性特例価格調整の適用について、年間販売額が予測販売額から10倍以上かつ3,000億円超に急拡大した場合に限り、引き下げ幅の上限値が50%から66.7%(2/3)に引き上げられます。
まとめ
令和8年度薬価制度改革は、3つの柱に基づいて実施されます。第一に、国民負担の軽減と創薬イノベーションの両立を目指し、新薬創出等加算を「革新的新薬薬価維持制度」に改称するとともに、長期収載品の薬価適正化を強化します。市場拡大再算定の類似品への適用は廃止され、企業の予見可能性が確保されます。第二に、後発品を中心とした医薬品の安定供給確保のため、価格帯集約ルールの見直しと最低薬価の引上げを実施します。第三に、高額医薬品に対しては、NDBによる使用量把握と再算定の適用強化により対応し、特に急拡大した品目については引下げ幅の上限を66.7%に引き上げます。
長期収載品の引下げの下限および円滑実施措置は廃止されますが、令和8年度薬価改定に限り経過措置として適用されます。
これらの改正は、令和8年4月から順次施行される予定です。医療機関および薬局においては、今後の通知等を確認の上、適切な対応をお願いします。
本稿は中央社会保険医療協議会 総会(第642回)の資料「令和8年度薬価改定に係る薬価算定基準の見直しについて(案)」に基づいて作成しています。