中央社会保険医療協議会(中医協)は令和8年1月16日の総会において、令和8年度保険医療材料制度の見直し案を了解しました。この見直しは、令和7年12月26日に了解された「令和8年度保険医療材料制度改革の骨子」に基づくものです。本稿では、特定保険医療材料の保険償還価格算定基準等の改正内容について、製造販売業者や医療機関の実務担当者向けに解説します。
今回の制度見直しは7分野で構成されますが、改正事項があるのは6分野です。イノベーションの評価、プログラム医療機器の評価、医療機器の安定供給、内外価格差の是正、市場拡大再算定、保険適用手続に係る事項において改正が行われます。主な改正点として、チャレンジ申請におけるデータの客観性担保の強化、プログラム医療機器の算定方法の明確化、小児用医療機器への配慮の拡充、不採算品再算定の対象拡大、保険適用手続の効率化が挙げられます。以下、各分野の改正内容を詳しく説明します。
イノベーションの評価:チャレンジ申請と体外診断用医薬品の見直し
イノベーションの評価に関する改正では、チャレンジ申請の厳格化と体外診断用医薬品の評価基準の明確化が主な内容です。これらの改正は、データの客観性を高め、臨床上の有用性に基づく適正な評価を実現することを目的としています。
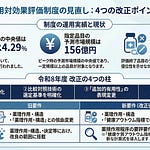
チャレンジ申請については、3つの観点から見直しが行われました。第一に、データ収集において原則として比較試験が求められます。ランダム化比較試験(RCT)が望ましいとされますが、RCTが困難な場合はバイアスのリスクを軽減する方法を十分に検討した研究計画を示す必要があります。チャレンジ権取得を希望する時点で既に開始されている臨床研究等についても、研究計画等の妥当性が示されれば評価対象となり得ることが明確化されました。
第二に、データ提出方法として査読付き論文の公表が必須となります。データの客観性を担保する観点から、審議の前提として査読付き論文として公表されたデータの提出が求められます。製造販売業者等による独自の解析等については、評価対象としないことが明確化されました。
第三に、手続の効率化として、実現可能性の高い研究計画については迅速な権利付与が可能となります。RCTであり実現可能性も高い研究計画については、事務局による事前確認を経て保険医療材料等専門組織(保材専)委員長が認めた場合に限り、保材専への報告をもってチャレンジ権を付与できます。一方、既存治療との比較が困難と判断されるものや実現可能性が認められないもの等については、チャレンジ権を付与せず、その理由を製造販売業者に伝達することとなりました。
体外診断用医薬品の保険適用における評価基準も明確化されました。製造販売業者が区分E3(新項目、改良項目)の保険適用を希望する体外診断用医薬品について、保材専が以下のいずれかに該当すると判断した場合はF区分となります。臨床上の位置づけ(対象患者、実施時期)が不明確である場合、臨床上の位置づけに応じた性能を有していない場合、当該検査の結果により治療が変化する等の臨床上の有用性が示されていない場合がこれに該当します。
希少疾病等の検査に用いる体外診断用医薬品等についても評価の拡充が図られました。想定される検査回数が少ない再生医療等製品の適応判定の補助に必要な検査に適用が拡大されます。技術料の見直しにおいて参照する準用技術料は、希少性の重複評価を避けるため、保険収載時に準用した技術料であることが明確化されました。
プログラム医療機器の評価:算定方法と選定療養の明確化
プログラム医療機器の評価に関する改正では、算定方法の明確化と選定療養の活用方法の見直しが行われました。これらの改正は、プログラム医療機器の適正な評価と患者への説明方法の柔軟化を目的としています。
特定保険医療材料として評価されるプログラム医療機器の算定方法が明確化されました。特定保険医療材料として評価されるプログラム医療機器については、初・再診料、プログラム医療機器指導管理料(導入期加算を含む)、その他の医学管理料等、特定保険医療材料料を組み合わせて算定できることが明示されました。この明確化により、製造販売業者が保険適用希望書を提出する際の算定イメージが具体化されます。
選定療養の活用方法についても見直しが行われました。主として患者が操作等を行うプログラム医療機器であって、保険適用期間の終了後において患者の希望に基づき使用することが適当と認められるものについて、選定療養を活用する場合があります。この場合、各医療機関が設定する特別の料金の徴収についての患者への説明は、患者が使用するプログラム医療機器のアプリケーション内で行うことも可能であることが明確化されました。
医療機器の安定供給:小児用医療機器と不採算品再算定
医療機器の安定供給に関する改正では、小児用医療機器への配慮の拡充、不採算品再算定の対象拡大、市場実勢価格が償還価格を上回る場合の対応が定められました。これらの改正は、医療現場への安定的な製品供給を確保することを目的としています。
小児用医療機器については、その特殊性への配慮が強化されました。小児用医療機器は、成長に伴い使用する医療機器のサイズが変化すること等の特殊性や対象患者数が少ないことに配慮が必要です。新規機能区分の基準材料価格が外国平均価格の0.8倍以下となる場合は、原価計算方式による算定を製造販売業者が希望できることとなりました。機能区分の細分化については、業界の要望等も踏まえつつ、薬事承認事項との整合性も確認しながら引き続き検討されます。
不採算品再算定の対象選定基準における「代替するものがないこと」の要件が拡充されました。従来のパターン1(1社でシェアの大半を占める場合)に加え、パターン2(上位2社で同一機能区分内のシェアの大半を占める場合)についても、両者が供給困難となった場合においては安定供給に支障をきたすと考えられるため、代替困難性に関する要件を満たすこととなりました。パターン3(シェアが分散している場合)については、他の製造販売業者が不足分を供給できないとまではいえないため、不採算品再算定での対応は行われません。
市場実勢価格が償還価格を上回る機能区分への対応も、シェア状況を踏まえて整理されました。パターン1及びパターン2においては、供給側の価格決定力が強いことが想定されるため、市場実勢価格に基づく保険償還価格の引き上げは行われません。パターン3については、競争的市場であり、市場実勢価格の加重平均値や物価変動等を参考にしつつ保険償還価格を設定することとなりました。
内外価格差の是正と市場拡大再算定
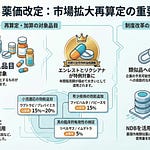
内外価格差の是正と市場拡大再算定に関する改正では、外国価格の算出方法の見直しと、市場拡大再算定の運用明確化が行われました。これらの改正は、適正な価格形成と制度の透明性向上を目的としています。
外国価格再算定における各国平均価格の算出方法が見直されました。アメリカ合衆国、連合王国、ドイツ、フランス及びオーストラリアの各国の平均価格については、外国価格調査の結果に加え、国内での使用状況等を考慮した加重平均により算出されます。外国平均価格については、従来どおり各国の平均価格を相加平均して算出します。
市場拡大再算定については、複数の運用が明確化されました。機能区分の見直しにおいて単に機能区分の名称のみが変更された場合は、名称変更前の機能区分の設定時期や予想年間販売額等を確認します。機能区分の見直しにより機能区分が新設された場合は、旧機能区分が設定された日から10年を経過した後の最初の材料価格改定以前か以後かによって、基準年間販売額の決定方法が異なります。チャレンジ申請により再評価を受け、機能区分が設定される際に原価計算方式以外の方式により算定された特定保険医療材料についても、市場拡大再算定の対象となり得ることが明確化されました。
技術料包括の医療機器及び体外診断用医薬品についても、市場拡大再算定の計算方法が新たに設定されました。改定後の技術料は、医療機器や体外診断用医薬品に係る金額の割合と市場規模拡大率を考慮した計算式により算出されます。技術料の見直しの対象については、保険医療材料等専門組織において検討した上で、中医協総会で議論することとなりました。
保険適用手続の効率化
保険適用手続に関する改正では、医療技術評価分科会での評価対象の明確化、適応判定用体外診断用医薬品の保険適用時期の特例、各種手続の簡素化など、複数の効率化措置が講じられました。これらの改正は、患者アクセスの向上と手続の迅速化を目的としています。
医療技術評価分科会での評価を要する場合の例示が見直されました。類似する既存技術に対する評価との整合性の観点から当該既存技術に対する評価を同時に見直す必要があるもの、保険適用されていない医療技術を実施する目的で使用する医療機器等、オンライン診療での実施に係る技術料がない医療技術をオンライン診療で実施することを目的とする医療機器等、複数分野で使用される医療機器等を用いた技術であり分野毎に異なる診療報酬点数が算定されるもの、管理料の新設についての審議が必要なものが該当します。評価療養の対象期間についても、患者アクセスの観点を踏まえ、直近の診療報酬改定の次の診療報酬改定での保険適用を想定した期間に見直されました。
医薬品等の適応判定を目的として使用される体外診断用医薬品については、保険適用時期の特例が設けられました。医療現場への円滑な導入を支える観点から、中医協において了承された保険適用日から保険適用することとなりました。
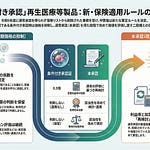
A3区分(既存技術・変更あり)の保険適用希望についても手続が簡素化されました。特定診療報酬算定医療機器の定義における一般的名称の追加のみ等を希望するものについては、事務局による事前確認を経て、希望内容が軽微な変更にとどまるものとして保材専委員長が認めた場合においては、保材専への報告をもって決定案とすることができます。
承認事項の一部変更承認等後の保険適用希望に係る取扱いも明確化されました。製造販売業者等が承認事項の一部変更承認等を行った後に保険適用希望書を提出する場合において、重複した議論を避けるため、保険適用希望が可能な内容は当該一部変更承認等に係る事項に限ることとされました。
軽微変更届に伴う保険適用希望書の提出も可能となりました。PMDAへの簡易相談を経て適切に軽微変更届が行われたもののうち、構成品やサイズバリエーションの追加、一般的名称の変更等に伴い決定区分B1(既存機能区分)を希望する場合に限り、保険適用希望書を提出できることとなりました。
保険適用希望書の様式についても見直しが行われました。適切なイノベーションの評価及び保険適用に係る迅速な手続の促進の観点から、特に重要な論点を踏まえつつ、簡潔に要点を整理して記載するよう様式が見直されます。
製造販売業者から不服申し立てがあった場合の取扱いも明確化されました。製造販売業者が保材専の決定に対して不服を申し立てる場合は、原則として不服意見書が提出された月の翌月に2回目の保材専を実施します。2回目の保材専後に期日内に企業からの同意が得られない場合は、保険適用希望書を取り下げたものとして取り扱われます。保険適用希望書の取り下げがあった場合でも、再度提出することは妨げられません。
まとめ
令和8年度保険医療材料制度の見直しは、イノベーションの適正評価、プログラム医療機器の算定明確化、医療機器の安定供給確保、保険適用手続の効率化を柱としています。チャレンジ申請では査読付き論文の提出が必須となり、データの客観性が重視されます。プログラム医療機器については、特定保険医療材料として評価される場合の算定方法が明確化されました。小児用医療機器や不採算品については、安定供給の観点から配慮が拡充されました。保険適用手続では、軽微な変更の簡素化、適応判定用体外診断用医薬品の保険適用時期の特例、様式の見直しなど、迅速化が図られています。製造販売業者は、これらの改正内容を踏まえた対応が求められます。